Karla ruby Maldonado
lunes, 10 de diciembre de 2012
viernes, 23 de noviembre de 2012
jueves, 8 de noviembre de 2012
viernes, 12 de octubre de 2012
jueves, 11 de octubre de 2012
viernes, 14 de septiembre de 2012
Punto de Fusion y ebullicion, y Disolventes polares y no polares
PUNTO DE
FUSION:
El punto de fusión de un sólido cristalino es la temperatura a la cual se
convierte en un líquido ala presión de una atmósfera. El punto de fusión se
indica como un rango de fusión. Normalmente la presión se ignora al determinar el
punto de fusión. El punto de fusión se determina calentando lentamente (aproximadamente un grado por minuto) una pequeña cantidad de material sólido. La temperatura a la cual se
observa la primera gota de líquido es la temperatura mas baja del rango de fusión. La
temperatura a la cual la muestra se convierte completamente en un líquido transparente es la temperatura
superior del rango de fusión. Así, un punto de fusión debe ser indicado,
por ejemplo, como p. f. 103.5°-105°.
PUNTO DE EBULLICIÓN:
Cuando se calienta un líquido, alcanza eventualmente una temperatura en la
cual la presión del vapor es lo bastante grande que se forman burbujas dentro
del cuerpo del líquido. Esta temperatura se llama punto ebullición. Una vez que
el líquido comience a hervir, la temperatura permanece constante hasta que todo
el líquido se ha convertido a gas. El punto ebullición normal del agua es 100
DISOLVENTES POLARES Y NO POLARES:
Disolvente polar:
Solventes
polares: Son sustancias en cuyas moléculas la distribución de la nube
electrónica es asimétrica; por lo tanto, la molécula presenta un polo positivo
y otro negativo separados por una cierta distancia. Hay un dipolo permanente.
El ejemplo clásico de solvente polar es el agua. Los alcoholes de baja masa
molecular también pertenecen a este tipo.
Los disolventes polares se pueden subdividir en solventes próticos y solventes apróticos. Un disolvente polar prótico contiene un enlace del O-H o del N-H. Un disolvente polar áprotico es un disolvente polar que no tiene enlaces O-H o N-H. Agua (H-O-H), etanol (CH3-CH2-OH) y ácido acético (CH3-C(=O)OH) son disolventes polares próticos. La acetona (CH3-C(=O)-CH3) es un disolvente polar aprótico.
Los disolventes polares se pueden subdividir en solventes próticos y solventes apróticos. Un disolvente polar prótico contiene un enlace del O-H o del N-H. Un disolvente polar áprotico es un disolvente polar que no tiene enlaces O-H o N-H. Agua (H-O-H), etanol (CH3-CH2-OH) y ácido acético (CH3-C(=O)OH) son disolventes polares próticos. La acetona (CH3-C(=O)-CH3) es un disolvente polar aprótico.
Disolvente
apolar:
Solventes apolares: En general son sustancias de tipo orgánico y en cuyas moléculas la distribución de la nube electrónica es simétrica; por lo tanto, estas sustancias carecen de polo positivo y negativo en sus moléculas. No pueden considerarse dipolos permanentes. Esto no implica que algunos de sus enlaces sean polares. Todo dependerá de la geometría de sus moléculas. Si los momentos dipolares individuales de sus enlaces están compensados, la molécula será, en conjunto, apolar. Algunos solventes de este tipo son: el dietiléter, cloroformo, benceno, tolueno, xileno, cetonas, hexano, ciclohexano, tetracloruro de carbono es el que disuelve o va a disolver, etc. Un caso especial lo constituyen los líquidos fluorosos, que se comportan como disolventes más apolares que los disolventes orgánicos convencionales.
Isotopos y tipos de enlaces Unidad I
Isotopos
en la Biología.
El
uso de isótopos estables en biología ha aumentado en los últimos años debido al
gran poder que tienen los isótopos para medir procesos que antes eran difíciles
o imposibles de cuantificar utilizando otros métodos. A pesar de que la mayoría
de los estudios con isótopos se han concentrado en zonas templadas, en años
recientes han aumentado los estudios realizados en los trópicos, lo cual ha
permitido entender en detalle procesos complejos. Esta revisión enfatiza
aquellos estudios que utilizan la composición isotópica de hidrógeno, carbono,
nitrógeno y oxígeno para estudiar procesos biogeoquímicos en ambientes
tropicales, tanto a escala molecular como regional. Al detallar los avances
recientes sobre estudios en los trópicos, se espera estimular más estudios en
esta área. También, con base en los resultados asombrosos que se obtienen
usando isótopos en biología tropical, se tiene certeza de que los isótopos
estables proporcionarán avances excitantes en el futuro.
Si la relación entre el número de protones y de neutrones no es la
apropiada para obtener la estabilidad nuclear, el isótopo es radiactivo.
Por ejemplo, en la naturaleza el carbono se presenta como una mezcla de tres isótopos con números de masa 12, 13 y 14: 12C, 13C y 14C. Sus abundancias respecto a la cantidad global de carbono son respectivamente: 98,89%, 1,11% y trazas.
Los isótopos se subdividen en isótopos estables (existen menos de 300)
y no estables o isótopos radiactivos (existen alrededor de 1.200). El
concepto de estabilidad no es exacto, ya que existen isótopos casi
estables. Su estabilidad se debe al hecho de que, aunque son
radiactivos, tienen una semivida extremadamente larga comparada con
la edad de la Tierra.
TIPOS DE
ENLACES:
Enlace químico:
Un enlace
químico es la unión entre dos o más átomos para formar una entidad de orden
superior, como una molécula o una estructura cristalina.
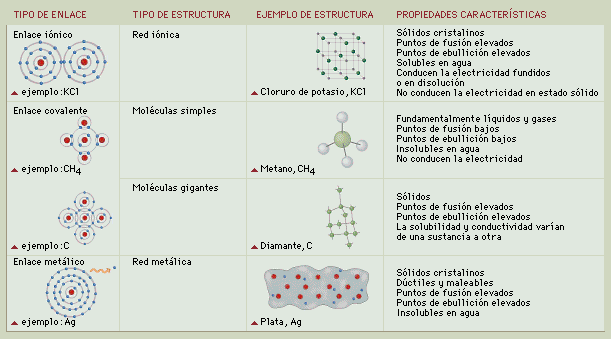
Enlace Covalente:
Enlace Covalente: las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe una electronegatividad polar, Se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones.
a su vez el enlace covalente se divide en :
Enlace Covalente Polar: se le denomina a asi a los enlaces en donde existe una diferencia de electronegatividad entre los átomos. Ejemplo: HF, HCl, CO, etc.
Enlace Covalente No Polar: se le denomina a así a los enlaces en el cual los átomos son de la misma especie y tienen una diferencia de electronegatividad nula. H2, O2. CH4,
Enlace Covalente Coordinado: Se denomina enlace covalente coordinado o dativo al enlace químico que se forma cuando dos átomos comparten un par de electrones, pero este par procede sólo de uno de los átomos. H2SO4.
Enlace Covalente:
Enlace Covalente: las reacciones entre dos átomos no metales producen enlaces covalentes. Este tipo de enlace se produce cuando existe una electronegatividad polar, Se forma cuando la diferencia de electronegatividad no es suficientemente grande como para que se efectúe transferencia de electrones.
a su vez el enlace covalente se divide en :
Enlace Covalente Polar: se le denomina a asi a los enlaces en donde existe una diferencia de electronegatividad entre los átomos. Ejemplo: HF, HCl, CO, etc.
Enlace Covalente No Polar: se le denomina a así a los enlaces en el cual los átomos son de la misma especie y tienen una diferencia de electronegatividad nula. H2, O2. CH4,
Enlace Covalente Coordinado: Se denomina enlace covalente coordinado o dativo al enlace químico que se forma cuando dos átomos comparten un par de electrones, pero este par procede sólo de uno de los átomos. H2SO4.
Enlace iónico:
El enlace
Iónico: es llamado también enlace electrovalente, este se forma por la unión de
un metal con un no metal formando así una sal. Los electrones de valencia se
transfieren de un átomo a otro; al hablar de valencia considerémosla como la
capacidad de combinación de un elemento para constituir un compuesto. Este
enlace es característico por la diferencia de electronegatividad mayor a 1.7
paulin. NaCl. KF, bicarbonato de sodio, etc.
Enlace metálico:
Un enlace
metálico es un enlace químico que mantiene unidos los átomos de los metales
entre sí. Estos átomos se agrupan de forma muy cercana unos a otros, lo que
produce estructuras muy compactas. Se trata de redes tridimensionales que
adquieren la estructura típica de empaquetamiento compacto de esferas.
El enlace de hidrógeno o puente de hidrógeno (correctamente llamado enlace por puente de hidrógeno) cuando un átomo de hidrógeno se encuentra entre dos átomos más electronegativos (N, O y F), estableciendo un vínculo entre ellos. El átomo de hidrógeno tiene una carga parcial positiva, por lo que atrae a la densidad electrónica de un átomo cercano en el espacio.
El enlace de hidrógeno es poco energético frente al enlace covalente corriente, pero su consideración es fundamental para la explicación de procesos como la solvatación o el plegamiento de proteínas.
H2O, HF, NH3, CH4.
El enlace de hidrógeno o puente de hidrógeno (correctamente llamado enlace por puente de hidrógeno) cuando un átomo de hidrógeno se encuentra entre dos átomos más electronegativos (N, O y F), estableciendo un vínculo entre ellos. El átomo de hidrógeno tiene una carga parcial positiva, por lo que atrae a la densidad electrónica de un átomo cercano en el espacio.
El enlace de hidrógeno es poco energético frente al enlace covalente corriente, pero su consideración es fundamental para la explicación de procesos como la solvatación o el plegamiento de proteínas.
H2O, HF, NH3, CH4.

Suscribirse a:
Entradas (Atom)


